|
 |
 |
|
ESTADO ACTUAL DE LA CIRUGÍA ONCOLÓGICA DIGESTIVA CON EL SISTEMA DA VINCI
RESUMENSe ha implementado la cirugía robótica en diversas patologías oncológicas digestivas con resultados adecuados en cuanto a la factibilidad y seguridad de los procedimientos.
El abordaje robótico de la patología hepatobiliar ha permitido resecciones complejas de tumores de difícil acceso y cercanos a vasos mayores. Se han realizado duodenopancreatectomías y pancreatectomías, facilitando la disección pancreática, ganglionar, la fase reconstructiva y aumentando la posibilidad de preservación esplénica. En las esofagectomías se describen procedimientos híbridos. Actualmente se realiza toracoscopia con asistencia robótica y el tiempo abdominal con laparoscopia convencional. La asistencia robótica en gastrectomías tiene ventajas técnicas en la linfadenectomía. En tumores estromales facilita las resecciones en cuña y la reconstrucción en gastrectomías parciales. Existe escasa evidencia del aporte de la robótica en cáncer de colon. Sin embargo en el recto aporta cada vez más beneficios. Aumenta las posibilidades de una adecuada escisión mesorrectal total, facilita las anastomosis manuales intracorpóreas y la extracción de la pieza por orificios naturales. Se ha demostrado que el abordaje robótico mantiene los mismos principios oncológicos que la cirugía abierta, con menor tasa de complicaciones, principalmente menor pérdida sanguínea, y menor tasa de conversión a abierta que la laparoscopia. El principal inconveniente es que prolonga los tiempos quirúrgicos. En general existe una experiencia corta en el tiempo y en el número de procedimientos, por lo que serían necesarios más estudios. PALABRAS CLAVE Cirugía robótica Da Vinci Cirugía Oncológica Cirugía Digestiva Cirugía mínimamente invasiva.
ABSTRACTIt has been demonstrated that robotic surgery is feasible and safety in the treatment of different digestive oncologic pathologies.
The robotic approach of hepatobiliary pathology allows complex resections of tumors with difficult access and near great vessels. Duodenopancreatectomies and pancreatectomies have been made, facilitating the pancreatic and ganglionary dissection, the reconstructive phase, and increasing the possibility of splenic preservation. Hybrid procedures are described in esophagectomies. At the moment thoracoscopy with robotic assistance plus abdominal time with conventional laparoscopy is been used. The robotic approach for gastrectomies has technical advantages in the lymphadenectomy. In stromal tumors it facilitates wedge resections and reconstructions in partial gastrectomies. There is few evidence of the contribution of robotic surgery in colon cancer. Nevertheless in rectal cancer it has many benefits. It increases the possibilities of a suitable total mesorectal excision, facilitates a manual intracorporeal anastomosis and the extraction of the specimen by natural orifices. It has been demonstrated that the robotic approach allows the same oncologic principles of open surgery with lower rates of complications, mainly less blood loss, and lower rate of conversion than laparoscopy. The main disadvantage is a prolonged operative time in most cases. In general there is a short experience in time and number of procedures, reason why more studies are necessary. PALABRAS CLAVE Robotic surgery Da Vinci Oncologic surgery Digestive surgerY Minimal invasive surgery.
ÍNDICE1. INTRODUCCIÓN 1.1. CONCEPTO DE LA CIRUGIA ROBÓTICA 1.2. DESCRIPCIÓN Y FUNCIONAMIENTO DEL SISTEMA DA VINCI 1.3. VENTAJAS E INCONVENIENTES 2. CIRUGIA HEPÁTICA ONCOLÓGICA 3. CIRUGIA PANCREÁTICA ONCOLÓGICA 4. CIRUGIA DEL CÁNCER DE ESÓFAGO 5. CIRUGIA DEL CÁNCER DE ESTÓMAGO 6. CIRUGIA DEL CÁNCER COLORRECTAL 7. BIBLIOGRAFÍA
1. INTRODUCCIÓN
1.1. CONCEPTO DE LA CIRUGIA ROBÓTICA Lo que ha dado en llamarse “cirugía robótica” no es más que la utilización del telemanipulador Da Vinci para asistir la cirugía laparoscópica. En realidad el sistema Da Vinci no es un robot, sino un sistema maestro-esclavo que traslada los movimientos del cirujano en la consola al campo quirúrgico (1). La verdadera novedad introducida por este sistema es el hecho de “separar” al cirujano del campo quirúrgico. Es lo que permite realizar telecirugía. La distancia que se puede establecer entre ambos depende de la calidad y la seguridad de las telecomunicaciones. En este momento solo está generalizado el trabajo desde la consola a escasos metros de la mesa del paciente (1,2). La “virtualidad” del acto quirúrgico realizado a distancia le proporciona enormes posibilidades de implementación, tanto en el brazo aferente del proceso (adquisición de la imagen) como en su brazo eferente (realización del acto quirúrgico propiamente dicho). Mejoras relacionadas con la visualización magnificada, microscópica en tiempo real o filtrada para distinguir bordes tumorales o vascularización de tejidos, y relacionadas con instrumental miniaturizado o “inteligente” o con la integración del quirófano o la posibilidad de simular los procedimientos a partir de información real de los pacientes, antes de llevarlos a la práctica en el paciente real (2,3). Las primeras experiencias robóticas publicadas en cirugía digestiva corresponden al grupo de Cadiére e Himpens (CHU Saint Pierre, Bruselas, Bélgica), con el predecesor del sistema Da Vinci, llamado Mona (Intuitive Surgical) (4,5,6). A principios de la década del 2000 también aparecieron reportes de cirugías a distancia intercontinentales (7,8). Las series iniciales con el robot Da Vinci en 2001 demostraron la factibilidad de los procedimientos (9,10,11,12). En España se introdujo el sistema Da Vinci en el sistema sanitario público en el año 2006, iniciándose así la adquisición de experiencia en cirugía digestiva en nuestro país (13,14,15).
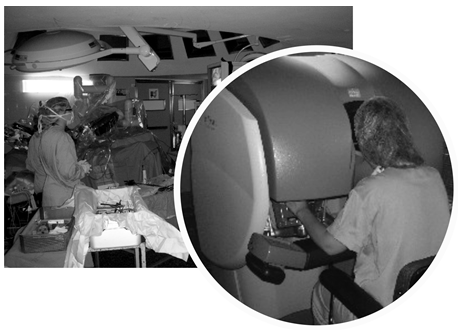
El sistema Da Vinci se compone de tres elementos: consola maestra, desde donde opera el cirujano, carro robotizado cuyos brazos se acoplan al instrumental, y torre o columna de visión (Fig. 1). Cada brazo del carro robotizado tiene un extremo articulado o “endomuñeca” que permite la manipulación de puntas de instrumental de 2 a 4 mm con siete grados de movimiento (13).
Figura 1. Equipo quirúrgico en la mesa y cirujano en la consola del robot Da Vinci durante la intervención
La visión del cirujano en la consola es tridimensional y está magnificada, produciendo la sensación de “inmersión” en el campo quirúrgico. Sus movimientos en los manipuladores se transmiten al paciente por los brazos del robot. El equipo que está en la mesa ajusta, realiza los cambios de instrumental necesarios y asiste a la cirugía desde trócares para acceso laparoscópico (13). El papel de la enfermería es fundamental: se ocupa de la preparación del sistema antes de cada intervención (posicionamiento, autochequeo, colocación de fundas estériles en los brazos del robot, puesta a punto del sistema óptico) y además ayuda al cirujano desde la mesa junto con el cirujano asistente (16). El abordaje laparoscópico se realiza de modo similar al habitual, utilizando trócares metálicos de 7 mm específicos del robot. El carro robotizado se coloca detrás del campo quirúrgico pero en el mismo eje y los brazos se acoplan a los puertos de la óptica y el instrumental. La óptica se conecta a una doble cámara que permite la visión tridimensional. Todos los instrumentos son reutilizables diez veces (13). 1.3. VENTAJAS E INCONVENIENTES Las ventajas que proporciona la utilización del sistema Da Vinci en la práctica habitual en la actualidad no se relacionan con la distancia establecida entre el cirujano y el paciente, ya que en este momento casi toda la cirugía robótica mundial se realiza con la consola a pocos metros de la mesa quirúrgica. Sin embargo existen ventajas derivadas de la “computerización” del acto quirúrgico: ausencia de temblor fisiológico, estabilidad y control de la visión por parte del cirujano, visión tridimensional, comodidad y ergonomía del cirujano (lo que redunda en beneficios para el paciente)… y otras derivadas del aumento en la movilidad y articulación del instrumental (mayor precisión y seguridad en la disección, mayor facilidad y comodidad en la realización de suturas…), todo lo cual en general permite aumentar las indicaciones y reducir las conversiones a abierta con respecto al abordaje laparoscópico tradicional (1,2,3). Entre los inconvenientes de la utilización del sistema Da Vinci, aparte del importante problema de su coste, se encuentran la falta de feedback táctil, que requiere de un aprendizaje hasta adquirir lo que ha dado en llamarse “tacto visual”, y la incomodidad que plantea la movilización del carro robótico si la intervención requiere del abordaje de distintos cuadrantes del abdomen (lo que ha hecho que se hayan desarrollado con frecuencia procedimientos híbridos, con parte laparoscópica y parte robótica) (1,2,3). En el presente capítulo nos proponemos poner al día la situación en lo referente al uso del robot Da Vinci para el tratamiento quirúrgico de la patología oncológica digestiva. Desde muy pronto se sospechó que sería de gran utilidad en muchos procedimientos, facilitando su realización con abordajes minimamente invasivos (17). El grupo de PC Giulianotti (Grossetto, Italia) fue pionero en la realización de la mayoría de los procedimientos de cirugía oncológica digestiva (18) y su aportación desde entonces ha sido notable, como se describe a continuación.
2. CIRUGIA HEPÁTICA ONCOLÓGICA(Resumen tabla 1)
La mayor parte de las publicaciones de cirugía hepática robótica son series de casos. Los grupos con mayor número de casos tienen entre 20 y 40 pacientes, habiendo un total de alrededor de 110 pacientes en la literatura publicada. Por lo tanto, en la actualidad existe una experiencia corta en el tiempo y en cuanto a número de procedimientos realizados. La cirugía hepática robótica puede realizarse con los mismos principios oncológicos que la cirugía abierta: márgenes negativos, sin manipulación directa del tumor, mediante resecciones anatómicas y con mínima pérdida sanguínea (19). Por lo tanto puede aplicarse al tratamiento laparoscópico de hepatocarcinoma, metástasis hepáticas colorrectales sincrónicas y de otros órganos, colangiocarcinoma, carcinoma de vesicula y hepatoblastoma. Permite resecciones complejas, de tumores localizados en segmentos de difícil acceso y cercanos a vasos mayores hepáticos (20). Se han descrito técnicas para resecciones anatómicas así como resecciones guiadas por ecografía con preservación de parénquima (21). La cirugía robótica permite trabajar de forma parecida a cómo se hace en cirugía abierta, facilitando la aplicación de la cirugía mínimamente invasiva en reconstrucciones biliares que no podían ser realizadas por laparoscopia (22,23). Todo esto con una menor tasa de complicaciones, incluyendo menores pérdidas sanguíneas intraoperatorias (24). La tasa de conversión es comparable o incluso menor a la de la cirugía laparoscópica (25). Una de las desventajas de la cirugía robótica es que prolonga los tiempos quirúrgicos, lo que puede deberse a la curva de aprendizaje (25). En el seguimiento a corto plazo los resultados son comparables con los de cirugía laparoscópica y abierta. Sin embargo, los resultados a largo plazo no pueden ser determinados, dado el corto tiempo de experiencia (26). El mayor tiempo de seguimiento hasta el momento ha sido de 34 meses de media (22). Debido a la heterogeneidad de los estudios realizados hasta el momento y a su baja evidencia científica, serían necesarios más estudios de calidad acerca del tratamiento de lesiones hepáticas malignas mediante cirugía robótica.
3. CIRUGÍA PANCREÁTICA ONCOLÓGICA(Resumen tabla 1)
La complejidad de la cirugía pancreática, incluso en su abordaje abierto, ha limitado mucho la difusión de su realización laparoscópica. En este sentido, la cirugía robótica puede aportar elementos técnicos (imagen tridimensional, articulación de los instrumentos, aumento de la precisión…) que permitan realizar disecciones complicadas y reconstrucciones complejas, permitiendo combinar las ventajas de la cirugía abierta y minimamente invasiva. Existen menos de 150 casos publicados de duodenopancreatectomía robótica (27). La serie más larga es de PC Giulianotti y cols: 60 pacientes con duodenopancreatectomia con y sin preservación pilórica, 45 de los cuales presentaban patología maligna, algunos con enfermedad localmente avanzada. Este trabajo describe una mortalidad del 3,3% y una incidencia de fístula pancreática del 31,7%. De acuerdo con estos autores, los aspectos técnicos que mejoran con la utilización del robot son: la disección del páncreas, la disección ganglionar, la creación del túnel retropancreático, la resección del proceso uncinado, y la fase reconstructiva (28). La incidencia de fístula pancreática publicada por un grupo de Pittsburg, en su serie de 36 pacientes con resección mayor pancreática, es del 20%. También describen un 8% de sangrado por seudoaneurismas, la mayoria de ellos secundarios a fístula pancreática. En el 87% de sus pacientes con malignidad consiguen bordes de resección R0 y obtienen una media de 18 ganglios linfáticos, asegurando así el estadiaje óptimo (29). En la literatura hay solo tres series de más de 15 pacientes de pancreatectomía distal robótica (28,30,31). En total, en torno a 100 casos (27). La ventaja real del abordaje robótico consiste en aumentar la posibilidad de preservación esplénica manteniendo las ventajas de la mínima invasión. La no preservación está asociada a mayor tasa de complicaciones a largo plazo y más complicaciones sépticas. La preservación de los vasos esplénicos consume tiempo, es laboriosa y requiere una disección minuciosa. Puede ser causa de sangrado intraoperatorio y de conversión. Los estudios comparativos muestran que la tasa mas alta de preservación esplénica se consigue con el uso del robot (30). Esto se hará más obvio a medida que se desarrollen las técnicas de detección de lesiones pancreáticas en fases más tempranas, lo que permitirá aumentar el volumen de casos con preservación esplénica (27). Hasta ahora se han publicado solo 13 casos de pancreatectomia central robótica (27). Aquí la indicación es crucial, la pancreatectomía con preservación de la función pancreática podría ser una variante a resecciones extensas para casos seleccionados, como lesiones pequeñas y asintomáticas, cercanas a la cabeza del páncreas. La complejidad de la técnica se asocia a un tiempo quirúrgico prolongado. La experiencia en la pancreatectomía total es mínima, solo 8 casos publicados (27). Podría ser una opción para resección de tumores neuroendocrinos multifocales, neoplasias intraductales papilares mucinosas difusas y pacientes con adenocarcinoma con múltiples focos. Todos los procedimientos se asocian a tiempo quirúrgico prolongado, pero con pérdida sanguínea menor que en la cirugía abierta. Diferentes series describen disminución del tiempo de estancia hospitalaria y recuperación más temprana, lo que a los pacientes oncológicos les permitiría someterse a tratamientos adyuvantes con menos demora. Solo dos estudios comparan costes: en Corea se observa un coste superior para el grupo robótico (30), mientras que en EEUU no se observan diferencias entre cirugía abierta, laparoscópica y robótica (31). El número de publicaciones está creciendo, pero la mayoría son series de casos analizados retrospectivamente. Solo existe hasta ahora una revisión sistemática. Pocos grupos comparan sus resultados con un procedimiento estándar y algunos comparan pacientes con diferentes indicaciones quirúrgicas. La resección pancreática e incluso extendida con reconstrucción compleja es segura y se puede realizar, pero supone alargar el tiempo quirúrgico. Desde el punto de vista oncológico, los resultados del abordaje robótico son parecidos a los de las series abiertas, pero teniendo en cuenta que los pacientes intervenidos por robot suelen seleccionarse. Para conseguir resultados satisfactorios y reducir la curva de aprendizaje es necesaria una gran experiencia en cirugía abierta. En España, la primera pancreatectomía robótica fue una distal con preservación esplénica y fue realizada en 2010 por el grupo de P. Bretcha (Hospital San Jaime de Torrevieja, Alicante) (32). Actualmente, la experiencia de este grupo se ha extendido a la pancreatectomía total (33). Otros grupos españoles están iniciando series de pancreatectomía en patología benigna y maligna (34).
Tabla I. RESUMEN DE CIRUGÍA ROBÓTICA HEPATOPANCREÁTICA ONCOLÓGICA. SITUACIÓN ACTUAL
4. CIRUGÍA DEL CÁNCER DE ESÓFAGO(Resumen tabla 2)
La patología oncológica del esófago puede implicar tres compartimentos anatómicos (abdomen, tórax y región cervical) por lo que es un desafío importante a la hora de proponer un abordaje minimamente invasivo. La mayoría de las esofaguectomías descritas han sido de carácter hibrido, es decir diferentes tipos de abordajes para los diferentes campos quirúrgicos. En este contexto el robot tuvo inicialmente un papel importante en la disección y linfadenectomia transhiatal. Se ha descrito una incidencia del 19,4% de incarceración de hernia hiatal tras la disección robótica trashiatal (35), quizá debido a la dilatación provocada por los brazos del robot durante el procedimiento (36). En el afán de encontrar un abordaje adecuado varias posiciones y técnicas han sido testadas. El paso obvio consistió en abordar el esófago mediante toracoscopia con asistencia robótica, dejando el tiempo abdominal a la laparoscopia convencional (37). En la actualidad se tiende a realizar este tiempo torácico en posición prona, lo que al parecer facilita la disección y tiene una baja incidencia de complicaciones pulmonares (38,39), aunque todavía no hay evidencia sólida de sus ventajas (40). En cuanto a resultados oncológicos, la mayor parte de los estudios publicados consigue resecciones completas (R0 en 95%) (41) y linfadenectomias adecuadas (37). Algunos estudios encuentran menor pérdida sanguínea (41) y menor estancia hospitalaria (42), pero un aumento significativo en el tiempo operatorio (41,42). El tiempo de acoplamiento del robot y el tiempo en la consola se reducen tras superar la curva de aprendizaje (43). Sin embargo la evidencia científica hasta el momento no se puede considerar óptima. En España, destaca la experiencia en cirugía robótica del cáncer de esófago del grupo de Esofagogástrica del Hospital de Basurto (Bilbao) (I. Díez, C. Loureiro), que se inició con el abordaje transhiatal (44) y actualmente está iniciando el abordaje torácico para realizar la anastomosis manual intratorácica en el Ivor-Lewis (45).
5. CIRUGÍA DEL CÁNCER DE ESTÓMAGO(Resumen tabla 2)
La seguridad y factibilidad de la gastrectomía por cáncer se puso en evidencia desde el principio (18,46). Existen series comparativas con laparoscopia, con cirugía abierta y con ambas, la mayoría retrospectivas. La experiencia laparoscópica previa se considera importante para el éxito de los procedimientos robóticos (47). Varios trabajos concluyen que la asistencia robótica tiene ventajas técnicas en la realización de la linfadenectomía (48,49,50), con el inconveniente de tener que abordar diferentes campos durante la intervención (49), pero con mejores resultados en cuanto a pérdida sanguínea (51) y estancia hospitalaria, en comparación con abierta y con laparoscópica (48,49,52). En general se considera que los resultados oncológicos son similares a abierta y laparoscópica, con una linfadenectomía adecuada (50,51), márgenes de resección R0 (53) y una supervivencia global a tres años similar a la del abordaje laparoscópico (54). Una revisión sistemática publicada en 2011 recogía los resultados de 10 estudios reportando 199 gastrectomías robóticas por cáncer (de las cuales 100 en un solo trabajo) y obtenía un 2,5% de conversión a abierta, una morbilidad del 15% y un tiempo quirúrgico más prolongado para la gastrectomía subtotal que para la total (55). Por otra parte, se han comunicado mejorías en las posibilidades técnicas de la intervención aumentando la indicación de abordaje minimamente invasivo cuando se utiliza la cirugía robótica en el tratamiento de los tumores estromales gástricos (56), con mayores posibilidades de realizar gastrectomías en cuña con márgenes libres (57) y con más facilidad para la reconstrucción en caso de gastrectomía parcial (58).
Tabla 2. RESUMEN DE CIRUGÍA ROBÓTICA ESOFAGOGÁSTRICA ONCOLÓGICA. SITUACIÓN ACTUAL
6. CIRUGÍA DEL CÁNCER COLORRECTALResumen Tabla 3
Las experiencias iniciales en el abordaje robótico del cáncer colorrectal fueron publicadas en 2002 y 2003 (18,59). Repasaremos brevemente tres grupos: colon derecho, colon izquierdo y recto. Existe escasa evidencia en la literatura sobre la aportación de la cirugía robótica a la cirugía del cáncer de colon derecho. En general, se han demostrado resultados adecuados en cuanto a la factibilidad de los procedimientos y en cuanto a sus resultados oncológicos (60,61,62). Sin embargo, se considera que el tiempo quirúrgico es más prolongado (60,61,62), y que el coste del procedimiento parece ser superior (62), en comparación con su equivalente laparoscópico. Este procedimiento por otra parte puede ser útil para iniciar el aprendizaje de la cirugía robótica colorrectal (62), y además puede facilitar la realización de las anastomosis manuales intracavitarias, dado que mejora en gran medida la visión y la facilidad para la realización de suturas (61). Otras ventajas considerables que puede tener la utilización del robot Da Vinci para este procedimiento se relacionan con la mínima incidencia de conversión a abierta (1.1%) y de complicaciones intraoperatorias (0.7%) que se ha reportado en una revisión sistemática reciente (63). En cuanto a la hemicolectomía izquierda, en general presenta tasas de complicaciones similares a las de la cirugía laparoscópica (64,65), y similares resultados oncológicos aunque algún grupo ha descrito mayor distancia al margen distal, así como mayor tiempo operatorio en el grupo robótico (66). También existe una tendencia de presentar menor tasa de conversión a cirugía abierta debido a que el sistema Da Vinci podría facilitar determinados pasos en la cirugía como por ejemplo el descenso del ángulo esplénico y la disección de los vasos mesentéricos inferiores (65,66). La experiencia mundial apunta a que la cirugía del cáncer de recto, a diferencia de las anteriores, se beneficia de forma cada vez más evidente del abordaje robótico. Esto es debido a que aumenta las posibilidades de realizar una escisión mesorrectal total de calidad (67), de extracción de la pieza por orificios naturales y de anastomosis manuales intracorpóreas (68). Se han descrito técnicas híbridas, robot asistido por laparoscopia para la movilización del ángulo esplénico (69) y la técnica “full robotic“, sin cambiar la posición del robot (64), lo que supondría una disminución en el tiempo operatorio. También se ha utilizado para la amputación abdominoperineal (70). Hasta ahora la evidencia científica no ha hallado diferencias significativas en cuanto al tiempo operatorio, pérdidas sanguíneas, estancia hospitalaria, morbi-mortalidad e inicio de la tolerancia oral, presentando resultados oncológicos aceptables cuando se lo compara con laparoscopia (71,72,73,74,75). En cambio parece evidente que la cirugía robótica para el cáncer de recto se asocia con menor tasa de conversión a abierta que el abordaje laparoscópico (71,72,73,74).
Tabla 2. RESUMEN DE CIRUGÍA ROBÓTICA COLORRECTAL ONCOLÓGICA. SITUACIÓN ACTUAL
7. BIBLIOGRAFÍA
1. E. Ortiz Oshiro, A. Ramos Carrasco, J. Alvarez Fernández-Represa. Cirugía Robótica (Cap. 16), en E.M. Targarona, X. Feliú, J.L. Salvador Guias Clínicas de la Asociación Española de Cirujanos. Cirugía Endoscópica (2ª Ed.). Ed. Arán Eds. Madrid 2010. P. 181-188 2. Herron DM, Marohn M. The SAGES – MIRA Robotic Surgery Consensus Group. A consensus document on robotic surgery. Surg Endosc 2008;22:313-325 3. E. Ortiz Oshiro. Entrevista al Prof. P. C. Giulianotti. SECLAEndosurgery nº 24 (Julio-Septiembre 2008). En Internet: http://www.seclaendosurgery.com/ seclan24/entrevista.htm. ISSN: 1698-4412 4. Himpens J, Leman G, Cadiére GB. Telesurgical laparoscopic cholecystectomy. Surg Endosc 1998;12:1091 5. Cadiére GB, Himpens J, Vertruyen M, Bruyns J, Fourtanier G. Nissen fundoplication done by remotely controlled robotic technique. Ann Chir 1999; 53(2):137-41 6. Cadiére GB, Himpens J, Vertuyen M, Favretti F. The world’s first obesity surgery performed by a surgeon at a distance. Obes Surg 1999;9(2):206-209 7. Cheah WK, Lee B, Lenzi JE, Goh PM. Telesurgical laparoscopic cholecystectomy between two countries. Surg Endosc 2000;14(11):1085 8. Marescaux J, Leroy J, Gagner M, Rubino F, Mutter D, Vix M et al. Transatlantic robot-assisted surgery. Nature 2001;27;413(6854): 379-380 9. Chitwood WR Jr, Nifong LW, Chapman WH, Felger JE, Bailey BM, Ballint T et al. Robotic surgical training in an academic institution. Ann Surg 2001;234(4):475-84. 10. Cadiére GB, Himpens J, Germay O, Izizaw R, Degueldre M, Vandromme J et al. Feasibility of robotic laparoscopic surgery: 146 cases. World J Surg 2001; 25(11):1467-77 11. Hanisch E, Markus B, Gutt C, Schmandra TC, Encke A. Robot-assisted laparoscopic cholecystectomy and fundoplication – initial experiences with the Da Vinci system. Chirurg 2001;72(3):286-8 12. Horgan S, Vanuno D. Robots in laparoscopic surgery. J Laparoendosc Adv Surg Tech A 2001;11(6):415-419 13. E. Ortiz Oshiro. Introducción de la Cirugía Robótica en la Red Sanitaria Pública Española. Incorporación de un robot da Vinci a la Cirugía del Hospital Clínico San Carlos de Madrid. Seclaendosurgery.com (en linea) 2006, nº 17. Disponible en Internet: http://www.seclaendosurgery.com/ seclan17/articulos/reportaje.htm. ISSN: 1698-4412. 14. E. Ortiz Oshiro, A. Ramos Carrasco, J. Alvarez Fernández-Represa. Editorial «Da Vinci o el avance en la minima invasión». SECLAEndosurgery nº 24 (Julio-Septiembre 2008). En Internet: http://www.seclaendosurgery.com/ seclan24/edit.htm ISSN: 1698-4412 15. Ortiz Oshiro E, Ramos Carrasco A, Moreno Sierra J, Pardo Martínez C, Galante Romo I, Bullon Sopelana F et al. Desarrollo multidisciplinario de la cirugía robótica en un hospital universitario de tercer nivel: organización y resultados. Cir Esp 2010;87(2):95-100 16. Mansilla García I, Escudero Mate M, García Rodríguez Y. Papel de la enfermería en el desarrollo de la cirugía robótica en el Hospital Clínico San Carlos. SECLAEndosurgery.com (en línea) 2007, nº 21. Disponible en Internet: http://www.seclaendosurgery.com/seclan21/articulos/art01.htm ISSN: 1698-4412 17. Hashizume M, Tsugawa K. Robotic surgery and cancer: the present state, problems and future vision. Jpn J Clin Oncol 2004;34(5):227-237 18. Giulianotti P, Coratti A, Angelini M, Sbrana F, Cecconi S, Balestracci T, Caravaglios G. Robotics in General Surgery: Personal Experience in a Large Community Hospital. Arch Surg 2003;138(7):777-784. 19. Choi GH, Choi SH, Kim SH, Hwang HK, Kang CM, Choi JS, Lee WJ. Robotic liver resection: technique and results of 30 consecutive procedures. Surg Endosc 2012;26(8):2247-58. Epub 2012 Feb 4. 20. Kitisin K, Packiam V, Bartlett DL, Tsung A. A current update on the evolution of robotic liver surgery. Minerva Chir 2011;66(4):281-93. 21. Casciola L, Patriti A, Ceccarelli G, Bartoli A, Ceribelli C, Spaziani A. Robot-assisted parenchymal-sparing liver surgery including lesions located in the posterosuperior segments. Surg Endosc 2011;25(12):3815-24 22. Giulianotti PC, Sbrana F, Coratti A, Bianco FM, Addeo P, Buchs NC et al. Robotic right hepatectomy: surgical technique and outcomes. Arch Surg 2011;146(7):844-50. 23. Giulianotti PC, Coratti A, Sbrana F, Addeo P, Bianco FM, Buchs NC et al. Robotic liver surgery. Results for 70 resections. Arch Surg 2011;149(1):29-39. 24. Berber E, Akyildiz HY, Aucejo F, Gunasekaran G, Chalikonda S, Fung J. Robotic versus laparoscopic resection of liver tumours. HPB (Oxford) 2010; 12(8):583-6. doi: 10.1111/j.1477-2574.2010.00234.x. 25. Ji WB, Wang HG, Zhao ZM, Duan WD, Lu F, Dong JH. Robotic-assisted laparoscopic anatomic hepatectomy in China: initial experience. Ann Surg 2011; 253(2):342-8. 26. Choi SB, Park JS, Kim JK, Hyung WJ, Kim KS, Yoon DS, Lee WJ, Kim BR. Early experiences of robotic-assisted laparoscopic liver resection. Yonsei Med J 2008;49(4): 632-8. 27. Buchs NC, Volonte F, Pugin F, Bucher P, Jung M, Morel P. Robotic pancreatic resection: how far can we go? Minerva Chir 2011;66:603-14 28. Giulianotti PC, Sbrana F, Bianco FM, Elli EF, Shah G, Addeo P et al. Robot-assisted laparoscopic pancreatic surgery: single surgeon experience. Surg Endosc 2010;24:1646-57 29. Zeh HJ, Zureikat AH, Secrest A, Dauoudi M, Bartlett D, Moser A. Outcomes after robot-assisted pancreatico-duodenectomy for periampullary lesions. Ann Surg Oncol 2012;19:864-70 30.Kang CM, Kim DH, Lee WJ, Chi HS. Conventional laparoscopic and robot-assisted spleen preserving pancreatectomy: does da Vinci have clinical advantage? Surg Endosc 2011;25:2004-09 31. Waters JA, Canal DF, Wiebke EA, Dumas RP, Beane JD, Aguilar-Saavedra JR et al. Robotic distal pancreatectomy: cost effective? Surgery 2010;148:814-823 32. Bretcha P, Farré J, Duarte M, Dussan C, Pino C. Video “Pancreatectomía distal con preservación esplénica robótica”. Seclaendosurgery.com (en linea) 2012, nº 38. Disponible en Internet: http://www.seclaendosurgery.com/index.php?option=com_content&view =article&id=81&Itemid=74. ISSN: 1698-4412. 33. Bretcha Boix P, Gutiérrez I, Farré Alegre J, Duarte M, Dussan C. Pancreatectomía total con esplenectomía asistida por sistema robótico Da Vinci. Comunicación video. XI Congreso Nacional de la SECLA. Madrid, mayo de 2012. 34. Vicente E, Quijano Y, Durán H, Díaz E, Fabra I, Puga R et al. Cirugía pancreática robótica. Resultados preliminares en un programa de reciente creación. Comunicación oral. XI Congreso Nacional de la SECLA. Madrid, mayo de 2012. 35. Sutherland J, Banerji N, Morphew J, Jonson E, Dunn D. Postoperative incidence of incarcerated hiatal hernia and its prevention after robotic transhiatal esophagectomy. Surg Endosc 2011;25:1526-30 36. Boone J, Verhage RJ, Van der Sluis PC, Van Hillegersberg R. Incarcerated hiatal hernia after robot-assisted esophagectomy transhiatal vs thoracoscopic approach (letter). Surg Endosc 2012;26:886-7 37. Van Hillegersberg R, Boone J, Draaisma WA, Broeders IA, Giezeman MJ, Borel Rinkes IH. First experience with robotic assisted thoracoscopic esophagolymphadenectomy for esophageal cancer. Surg Endosc 2006;20: 1435-39 38. Puntambekar SP, Rayate N. Robotic transthoracic esophagectomy in the prone position. Experience with 32 patients with esophageal cancer. J Thorac Cardiovasc Surg 2011;142:1283-4 39. Suda K, Ishida Y, Kawamura Y, Kazuki I, Kanaya S, Teramukai S et al. Robot-assisted thoracoscopic lymphadenectomy along the left recurrent laringeal nerve for esophageal squamous cell carcinoma in the prone position: technical report and short-term outcomes. World J Surg 2012;36: 1608-16 40. Jarral OA, Purkayastha S, Athanasiou T, Darzi A, Hanna GB, Zacharakis E. Thoracoscopic esophagectomy in the prone position. Surg Endosc 2012; 26(8):2095-103 41. Clark J, Sodergren MH, Purkayastha S, Mayer EK, James D, Athanasiou T et al. The role of robot-assisted laparoscopy for esophagogastric oncological resection: an appraisal of the literature. Dis Esophagus 2011;24(4):240-50. 42. Boone J, Schipper ME, Moojen WA, Borel Rinkes IH, Cromheecke GJ, Van Hillegersberg R. Robot-assisted thoracoscopic oesophagectomy for cancer. Br J Surg 2009;96(8):878-886. 43. Kim DJ, Hyung WJ, Lee CY, Lee JG, Haam SJ, Park IK, Chung KY. Thoracoscopic esophagectomy for esophageal cancer: feasibility and safety of robotic assistance in the prone position. J Thorac Cardiovasc Surg 2010; 139(1):53-59. 44. Loureiro C, Díez I, Esteban J, Cotano JR, Cruz I, García M, Barrenetxea J, Méndez JJ. Video “Esofaguectomía transhiatal asistida por robot”. Seclaendosurgery.com (en linea) 2012, nº 38. Disponible en Internet: http://www.seclaendosurgery.com/index.php? option=com_content&view=article&id=184&Itemid=188. ISSN: 1698-4412. 45. Loureiro González C, Díez del Val I, Pérez de Villarreal Amilburu P, Ruiz Carballo S, Leturio Fernández S, Bilbao Axpe JE, Méndez Martín JJ. Aportación de la robótica en una unidad de cirugía esofagogástrica. Comunicación oral. XI Congreso Nacional de la SECLA. Madrid, mayo de 2012. 46. Anderson C, Hellan M, Kernstine K, Ellenhorn J, Lai L, Trisal V, Pigazzi A. Robotic surgery for gastrointestinal malignancies. Int J Med Robot 2007;3(4):297-300. 47. Song J, Kang WH, Oh SJ, Hyung WJ, Choi SH, Noh SH. Role of robotic gastrectomy using da Vinci system compared with laparoscopic gastrectomy: initial experience of 20 consecutive cases. Surg Endosc 2009;23(6):1204-11. 48. Guzmán EA, Pigazzi A, Lee B, Soriano PA, Nelson RA, Benjamín Paz I et al. Totally laparoscopic gastric resection with extended lymphadenectomy for gastric adenocarcinoma. Ann Surg Oncol 2009;16(8):2218-23. 49. Kim MC, Heo GU, Jung GJ. Robotic gastrectomy for gastric cancer: surgical techniques and clinical merits. Surg Endosc 2010;24(3):610-15 50. Song J, Oh SJ, Kang WH, Hyung WJ, Choi SH, Noh SH. Robot-assisted gastrectomy with lymph node dissection for gastric cancer: lessons learned from an initial 100 consecutive procedures. Ann Surg 2009;249(6):927-932. 51. Woo Y, Hyung WJ, Pak KH, Inaba K, Obama K, Choi SH, Noh SH. Robotic gastrectomy as an oncologically sound alternative to laparoscopic resections for the treatment of early-stage gastric cancers. Arch Surg 2011;146(9): 1086-1092. 52.Huang KH, Lan YT. Initial experience of robotic gastrectomy and comparison with open and laparoscopic gastrectomy for gastric cancer. J Gastrointest Surg 2012;16(7):1303-10 53. D’Annibale A, Pende V, Pernazza G, Monsellato I, Mazzocchi P, Lucandri G et al. Full robotic gastrectomy with extended (D2) lymphadenectomy for gastric cancer: surgical technique and preliminary results. J Surg Res 2011; 166(2):e113-20 54. Pugliese R, Maggioni D, Sansonna F, Constanzi A, Ferrari GC, Di Lemia S et al. Subtotal gastrectomy with D2 dissection by minimally invasive surgery for distal adenocarcinoma of the stomach: results and 5-year survival. Surg Endosc 2010;24:2594-2602. 55. Buchs NC, Bucher P, Pugin F, Morel P. Robot assisted gastrectomy for cancer. Minerva Gastroenterol Dietol 2011;57(1):33-42. 56. Sierra Barbosa D, Ortiz Oshiro E, Díaz González J, Benito Expósito P, Cubero A, Morales Y et al. Video “Antrectomía laparobótica por GIST”. Seclaendosurgery.com (en linea) 2012, nº 38. Disponible en Internet: http://www.seclaendosurgery.com/index.php?option= com_content&view=article&id=192&Itemid=188. ISSN: 1698-4412. 57. Buchs NC, Bucher P, Pugin F, Hagen ME, Morel P. Robot-Assisted Oncologic Resection for Large Gastric Gastrointestinal Stromal Tumor: A Preliminary Case Series. J Laparoendosc Adv Surg Tech 2010;20(5):411-15. 58. Ortiz Oshiro E, Benito Exposito P, Moreno Sierra J, Diaz Gonzalez J, Sierra Barbosa D, Alvarez Fernández-Represa J. Laparoscopic and robotic distal gastrectomy for gastrointestinal stromal tumor. Case report. Int J Med Robot 2012;8:491-495. 59. Hashizume M, Shimada M, Tomikawa M, Ikeda I, Takahashi I, Abe R et al. Early experiences of endoscopic procedures in general surgery assisted by a computer enhanced surgical system. Surg Endosc 2002;16:1187-91. 60. Spinoglio G, Summa M, Priora F, Quaranti R, Testa S. Robotic colorectal surgery: first 50 cases experience. Dis Colon Rectum 2008;51:1627-1632. 61. D’Annibale A, Pernazza G, Morpurgo E, Monsellato I, Pende V, Lucandri G et al. Robotic right colon resection: evaluation of first 50 consecutive cases for malignant disease. Ann Surg Oncol 2010;17:2856-2862 62. De Souza AL, Prasad LM, Park JJ, Marecik SJ, Blumetti J, Abcarian H. Robotic assistance in right hemicolectomy: is there a role? Dis Colon Rectum 2010;53:1000-1006 63. Antoniou SA, Antoniou GA, Koch OO, Pointner R, Granderath FA. Robot-assisted laparoscopic surgery of the colon and rectum. Surg Endosc 2012;26:1-11. 64. Luca F, Cenciarelli S, Valvo M, Pozzi S, Faso FL, Ravizza D et al. Full robotic left colon and rectal câncer resection: technique and early outcome. Ann Surg Oncol 2009;16:1274-78. 65.D’Annibale A, Morpurgo E, Fiscon V, Trevisan P, Sovernigo G, Orsini C, Guidolin D. Robotic and laparoscopic surgery for treatment of colorectal diseases. Dis Colon Rectum 2004;47:2162-68 66. Jiménez Rodríguez RM, Díaz Pavón JM, De la Portilla de Juan F, Prendes Sillero E, Hisnard-Cadet Dussort JM, Padillo J. Estudio prospectivo aleatorizado: cirugía laparoscópica con asistencia robótica versus cirugía laparoscópica convencional en la resección del cáncer colorrectal. Cir Esp 2011;89:432-438. 67. Ortiz Oshiro E. Editorial Cirugía robótica del cáncer de recto. Seclaendosurgery.com (en linea) 2011, nº 35. Disponible en Internet: http://www.seclaendosurgery.com/index.php? option=com_content&view=article&id=133&Itemid=132. ISSN: 1698-4412. 68. Leong QM, Son DN, Cho JS, Baek SJ, Kwak JM, Amar AH, Kim SH. Robot-assisted intersphinteric resection for low rectal cancer: technique and short-term outcome for 29 con secutive patients. 69. Pigazzi A, Ellenhorn JD, Ballantyne GH, Paz IB. Robotic assisted laparoscopic low anterior resection with total mesorectal excision for rectal cancer. Surg Endosc 2006;20:1521-25. 70. González Poveda I, Mera Velasco S, Ruiz López, Carrasco Campos, Toval Mata. Técnica paso a paso “Amputación abdominoperineal laparoscópica asistida por Da Vinci”. Seclaendosurgery.com (en linea) 2012, nº 38. Disponible en Internet: http://www.seclaendosurgery.com/index.php?option=com_content&view=article&id=181&Itemid=189. ISSN: 1698-4412. 71. Ortiz Oshiro E, Sánchez Egido I, Moreno Sierra J, Fernández Pérez C, Sánchez Díaz J, Alvarez Fernández-Represa J. Robotic assistance may reduce conversion to open in rectal carcinoma laparoscopic surgery. Systematic review and metaanalysis. Int J Med Robot 2012 Mar 22. doi: 10.1002/rcs.1426. [Epub ahead of print] 72. Trastulli S, Farinella E, Cirocchi R, Cavaliere D, Avenia N, Sciannameo F et al. Robotic resection compared with laparoscopic rectal resection for cancer: systematic review and meta-analysis of short-term outcome. Colorectal Dis 2011;14(4):e134-56 73. Lin S, Jiang H, Chen Z, Zhou S, Liu X, Yu J. Meta-analysis of robotic and laparoscopic surgery for treatment of rectal cancer. World J Gastroenterol 2011;17(47):5214-20 74. Memon S, Heriot AG, Murphy DG, Bressel M, Lynch AC. Robot vs lap proctectomy for rectal cancer: a meta-analysis. Ann Surg Oncol 2012;19: 2095-2101 75. González-Fernández AM, Mascareñas González JF. Escisión mesorrectal total laparoscópica vs asistida por robot en el tratamiento del cáncer de recto: un metaanálisis. Cir Esp 2012;90(6):348-354 |